硫酸铝的化学式怎么书写 高中化学中钠、镁、铝相关试题解析
硫酸铝的化学式怎么书写 高中化学中钠、镁、铝相关试题解析

一、钠及其化合物
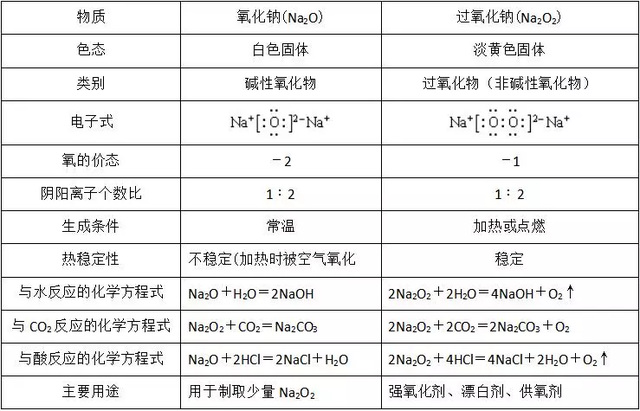
1、氧化钠和过氧化钠:Na2O和Na2O2的比较
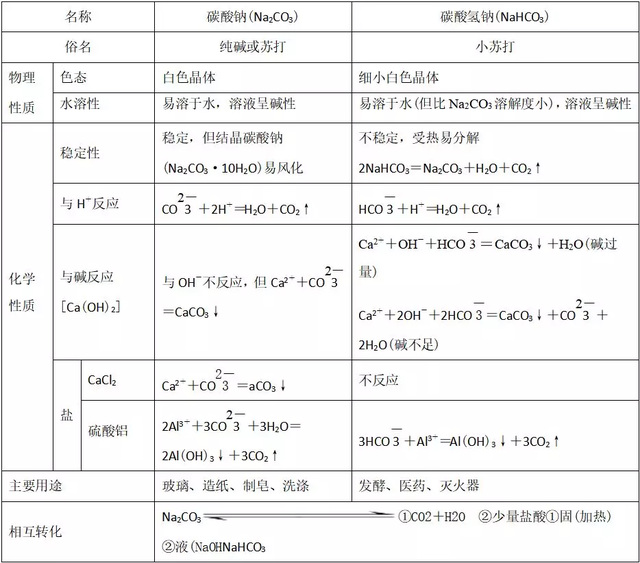
2、碳酸钠与碳酸氢钠

⑤Na2O2具有漂白性,投入品红溶液中,可使品红溶液褪色。


(1)热稳定性不同:

(2)和酸反应生成气体的速率不同(相同条件下)

(3)阴离子不同:
(4)溶液的酸碱性不同:
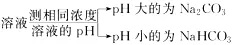
二、铝及其化合物
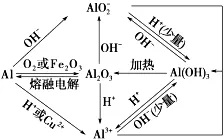
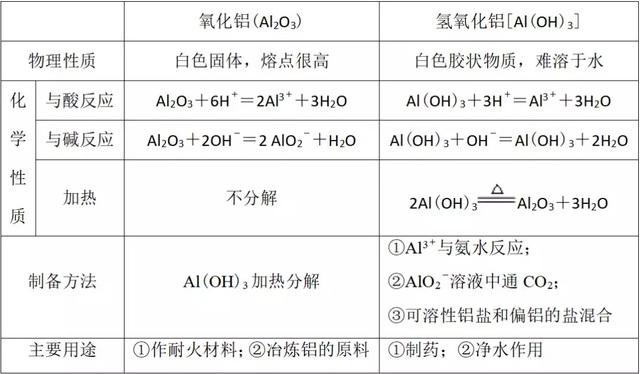
1、氧化铝和氢氧化铝
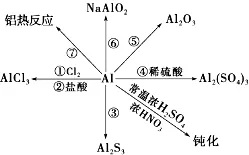
2.常见的铝盐:
(1)硫酸铝钾[KAl(SO4)2]是由两种不同的金属离子和一种酸根离子组成的复盐。
(2)明矾的化学式为:KAl(SO4)2·12H2O,它是无色晶体,可溶于水,水溶液pH<7。明矾可以净水,其净水的原因是:Al3++3H2O≒Al(OH)3(胶体)+3H+,Al(OH)3胶体且有较大表面积能吸附水中杂质形成沉淀而净水。
注意:
明矾的净水作用与液氯对自来水的消毒作用原理不同。明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,而液氯只能杀菌消毒,不能沉淀悬浮的杂质。
1、“铝三角”之间的转化
(1)“铝三角”之间的转化:
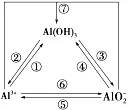
(2)有关Al(OH)3沉淀的计算:
①Al3++3OH-===Al(OH)3↓、②Al(OH)3+OH-=== AlO2-+2H2O
由①②得:③Al3++4OH-=== AlO2-+2H2O,则
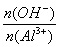
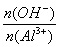
3<
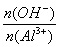
2、有关铝及其化合物的反应图像
(1)反映Al3+、Al(OH)3、AlO2-之间转化的有关图像:
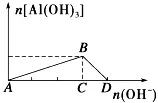
a、把强碱溶液逐滴加入到铝盐(Al3+)溶液中至过量
①现象:先有白色沉淀产生,然后沉淀逐渐溶解。
②有关反应:A→B:Al3++3OH-===Al(OH)3↓、B→D:Al(OH)3+OH-===AlO2-+2H2O
③图像:
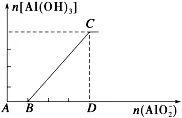
b、把铝盐(Al3+)溶液逐滴加入到强碱溶液中至过量
①现象:先无明显现象,然后逐渐产生大量的白色沉淀。
②有关反应:A→B:Al3++4OH-===AlO2-+2H2O、B→C:Al3++3 AlO2-+6H2O===4Al(OH)3↓
③图像:
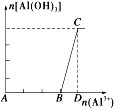
c、在AlO2-溶液中逐滴加入强酸至过量
①现象:先生成白色沉淀,随后沉淀逐渐溶解。
②有关反应:A→B:AlO2-+H++2H2O===Al(OH)3↓、B→D:Al(OH)3+3H+===Al3++3H2O
③图像:
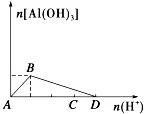
d、在强酸溶液中逐滴加入AlO2-溶液至过量:
①现象:先无明显现象,反应一段时间后逐渐产生白色沉淀。
②有关反应:A→B:4H++AlO2-===Al3++4H2O、B→C:Al3++3 AlO2-+6H2O===4Al(OH)3↓
③图像:
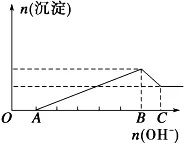
e、向含Mg2+和Al3+的酸性溶液中逐滴加入强碱溶液:
①现象:无明显现象→出现沉淀→渐多→最多→减少→不变
②反应:O→A:H++OH-===H2O、A→B:Al3++3OH-===Al(OH)3↓、Mg2++2OH-===Mg(OH)2↓、B→C:Al(OH)3+OH-===AlO2-+2H2O。
③图像[c(Mg2+)=c(Al3+)]:
(2)反映Al3+、Al(OH)3、AlO2-之间转化的计算——数轴分析与图表法
①根据AlCl3与NaOH的量计算生成Al(OH)3的量:
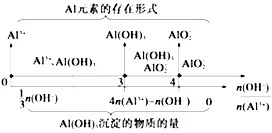
②根据AlCl3与Al(OH)3的量计算需要NaOH的量
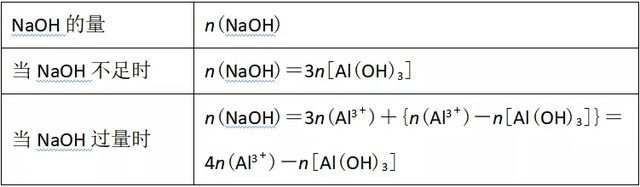
③根据NaAlO2与HCl计算生成Al(OH)3的量:
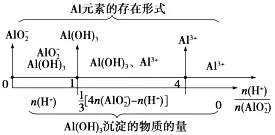
④根据Al(OH)3和NaAlO2的量计算需要加入的HCl的量

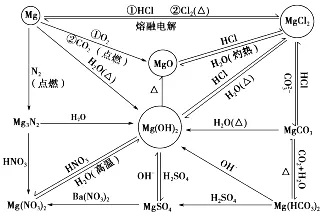
三、镁及其化合物
镁及其化合物的转化关系图:

相关问答
-
印度属于什么气候 亚洲气候类型分布图

亚洲气候类型分布图这里集中了所有热带季风气候、亚热带季风气候和温带季风气候,这三种季风气候,如果从国家的角度来看,印度和中国都
阅读更多 -
澳洲留学需要几年 澳洲留学时间的多样性

澳洲留学一般需要2-4年时间,具体因个人情况而定。本文将从不同留学层次、学习方式、签证类型等多个角度详细解答这一问题。
阅读更多 -
试算平衡的含义 试算平衡的分类

所谓试算平衡就是根据借贷记账法的“有借必有贷,借贷必相等”的平衡原理,检查和验证账户记录正确性的一种方法。试算平衡工作是通
阅读更多 -
高端简短的生日文案4篇

年年岁岁花相似,岁岁年年人不同。时光荏苒,岁月变迁。祝生日快乐!学问吧为大家精心整理了高端简短的生日文案4篇,在大家参照的同时,也
阅读更多 -
2021四川高校名单总人数(四川共有高等学校147所)

2021年,全省共有幼儿园1.34万所。在园幼儿261.76万人,其中,普惠性幼儿园在园幼儿224.42万人,普惠性幼儿园覆盖率达到85.73%。共有学前
阅读更多 -
历史剧林则徐观后感200字左右(看了历史剧林则徐有什么启示)

近日,由国家大剧院与广州话剧艺术中心联合制作的话剧《林则徐》成功首演。鸦片战争是中国近代史的开端,对中国人民的历史记忆和家国
阅读更多
最新问答
-

人教版一年级数学寒假作业训练题下载
2024-05-05 -

小学数学一年级上册冀教版电子课本
2024-05-05 -

新北师版一年级数学下册知识点
2024-05-05 -

数学一年级下册人教版电子课本
2024-05-05 -

怎样准备小学数学面试
2024-05-05 -

小学一年级上册数学应用题可打印
2024-05-05 -

小学一年级数学寒假练习题大全
2024-05-05 -

小学三年级下册数学专题练习题
2024-05-05 -

小学生数的认识
2024-05-05 -

一年级数学下册北京版电子教材
2024-05-05