乙醛的银镜反应实验第14(2022海淀化学试卷)
北京市东城区2021-2022学年度第二学期高三综合练习(二)
化学 2022.5
本试卷共10页,100分。考试时长90分钟,考生务必将答案答在答题卡上,在试卷上作答无效。考试结束后,将答题卡交回。
可能用到的相对原子质量:H 1 C 12 O 16
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.下列说法不正确的是( )
A. 原子光谱可用于鉴定氢元素
B. 电解法可用于冶炼铝等活泼金属
C. 分馏法可用于提高石油中乙烯的产量
D. 焰色试验可用于区分NaCl和KCl
2. 下列事实一定能说明CH3COOH是弱电解质的是
A. CH3COOH属于有机化合物
B. CH3COOH能与乙醇发生酯化反应
C. 用CH3COOH溶液做导电实验,灯泡较暗
D. 常温下,0.1 mol·L-1 CH3COOH溶液的pH约为3
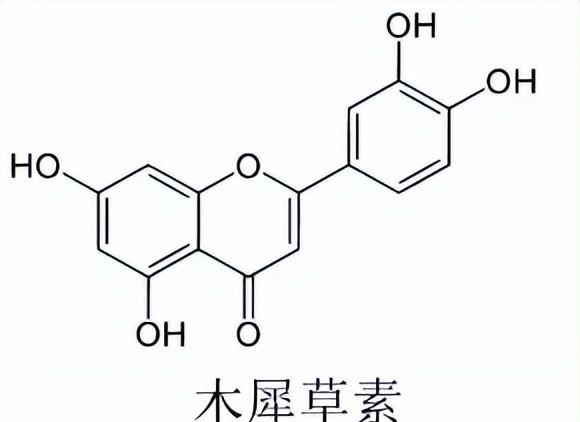
3. 木犀草素有镇咳化痰的作用,其结构简式如右图。
下列说法不正确的是
A. 分子中有3种含氧官能团
B. 分子中碳原子均为sp2杂化
C. 能与NaHCO3溶液反应,产生气泡
D. 能与Br2发生取代反应和加成反应
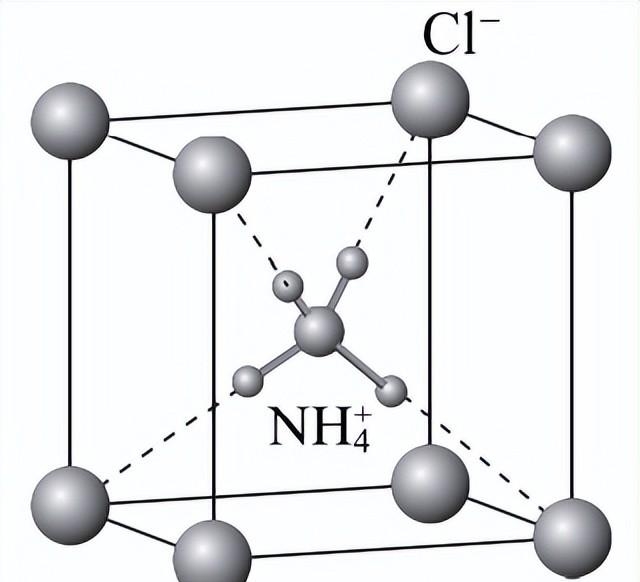
4. NH4Cl的晶胞为立方体,其结构如下。下列说法不正确的是
A. NH4Cl晶体属于离子晶体
B. NH4Cl晶胞中H-N-H键角为90°
C. NH4Cl晶体中既有离子键又有共价键
D.每个Cl-周围与它最近且等距离的NH4+的数目为8
5. 下列离子检验利用了氧化还原反应的是
|
选项 |
待检验离子 |
检验试剂 |
|
A |
Fe3+ |
KSCN溶液 |
|
B |
I- |
Cl2、淀粉溶液 |
|
C |
SO42- |
稀盐酸、氯化钡溶液 |
|
D |
NH4+ |
浓NaOH溶液、湿润的红色石蕊试纸 |
6. 下列解释事实的方程式不正确的是
A. NO遇空气变红棕色:2NO + O2 === 2NO2
B. 用NaOH溶液吸收Cl2:OH- + Cl2 === HClO + Cl-
C. 明矾净水:Al3+ + 3H2O Al(OH)3(胶体) + 3H+
D. 向AgI悬浊液中滴加Na2S溶液,沉淀变黑:
2AgI(s) + S2-(aq) Ag2S(s) + 2I-(aq)
7. 酸醇树脂广泛用于涂料行业。一种酸醇树脂P的结构片段如下图所示(“

”表示链延长)。下列说法不正确的是
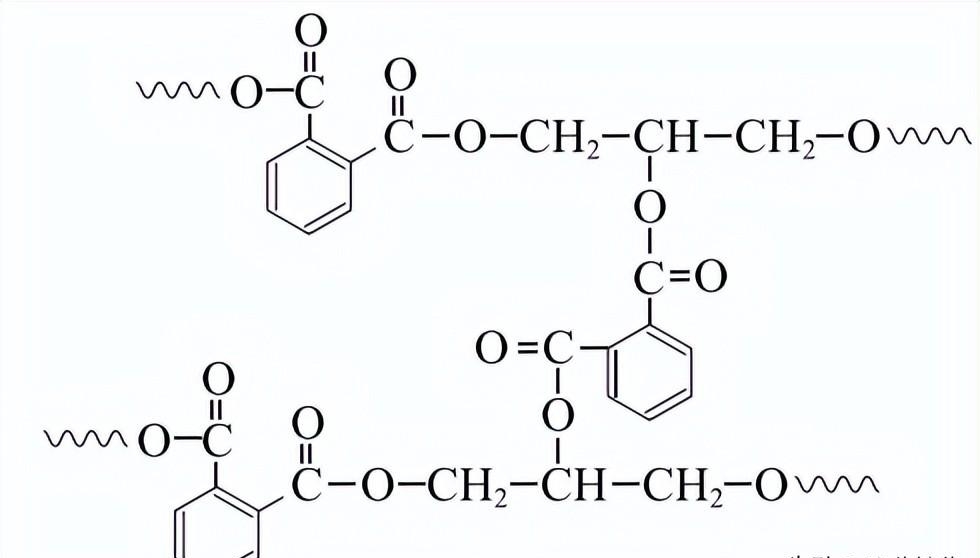
A. 树脂P为线型高分子 B. 树脂P可发生水解反应
C. 树脂P可由缩聚反应制得 D. 合成树脂P的一种单体是甘油
8.下列实验操作一定能达到实验目的的是
|
选项 |
实验目的 |
实验操作 |
|
A |
除去乙炔中少量的H2S |
将混合气通过盛有足量CuSO4溶液的洗气瓶 |
|
B |
验证淀粉能发生水解反应 |
将淀粉和稀硫酸混合后加热煮沸,冷却后加入新制Cu(OH)2悬浊液 |
|
C |
验证干燥的Cl2没有漂白性 |
将红色鲜花放入盛有干燥Cl2的集气瓶中 |
|
D |
检验CH3CH2Br中的Br |
加入足量稀硝酸,再滴加稀AgNO3溶液 |
9. 硝基苯甲酸乙酯(O2NC6H4COOC2H5)在碱性条件下发生水解反应:
O2NC6H4COOC2H5 + OH- O2NC6H4COO- + C2H5OH
两种反应物初始浓度均为0.05 mol·L-1,测得O2NC6H4COOC2H5的转化率α随时间t变化曲线如下图所示(忽略溶液体积变化)。下列说法不正确的是
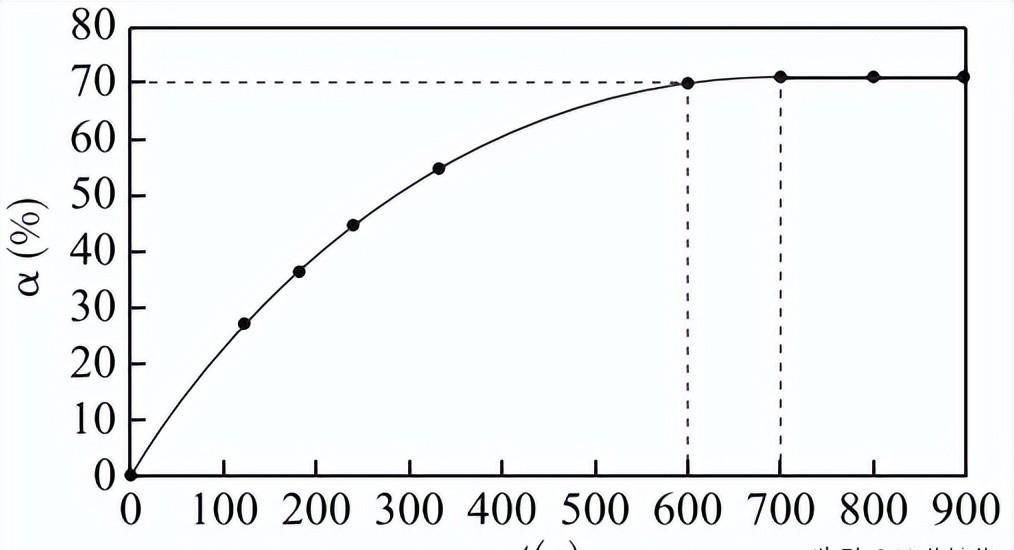
A. t=700s时,反应达到平衡状态
B. t=600s时,硝基苯甲酸乙酯的浓度为0.015 mol·L-1
C. 达到平衡之前,随着反应的进行硝基苯甲酸乙酯水解速率逐渐减小
D. 其他条件不变,提高c(OH-),可使该反应的化学平衡常数增大
10.下图是计算机模拟的在催化剂表面上水煤气变化的反应历程。 吸附在催化剂表面的物种用“∗”标注。
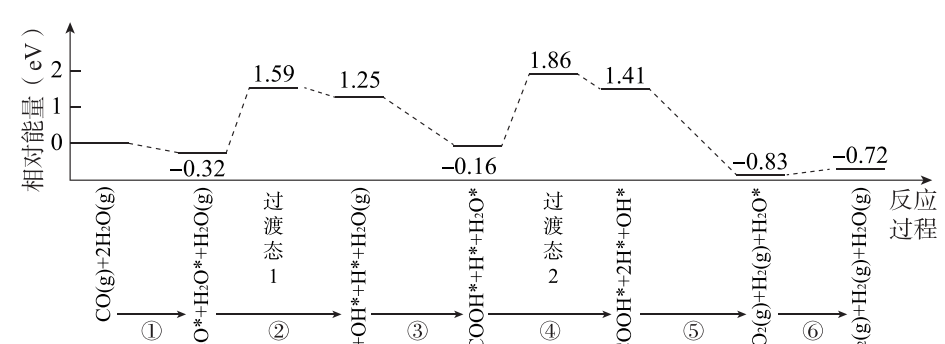
下列说法正确的是
A. ①表示CO和H2O从催化剂表面脱离的过程
B. ②和④中化学键变化相同,因此吸收的能量相同
C. 由图可知CO(g) + H2O(g) === CO2(g) + H2(g)为吸热反应
D. 本历程中的催化剂通过改变水煤气变化反应的焓变,来实现改变其反应速率
11. 家庭常用的一种储水式电热水器的结构如下图所示,其中a、b为水管口。
下列说法不正确的是
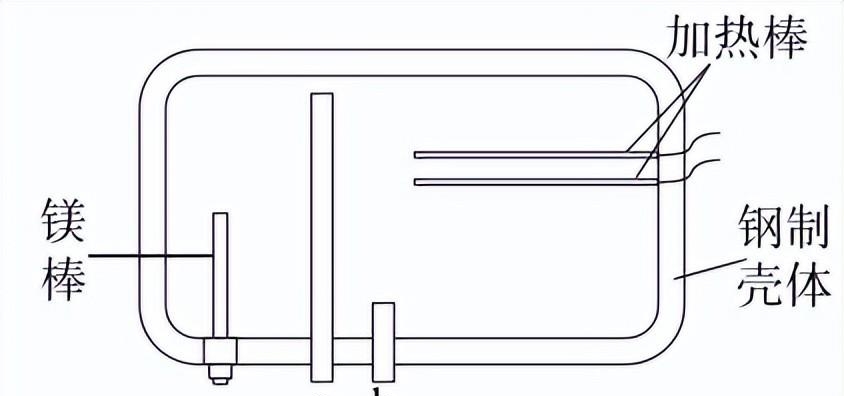
A.电热水器可将电能转化为热能
B. 该热水器采用了牺牲阳极的电化学保护法
C. 镁棒可以有效防止内部水垢生成
D. a应为出水口,b应为进水口
12. CO2资源化利用是实现碳中和的一种有效途径。下图是CO2在电催化下产生合成气(CO和H2)的一种方法。下列说法不正确的是
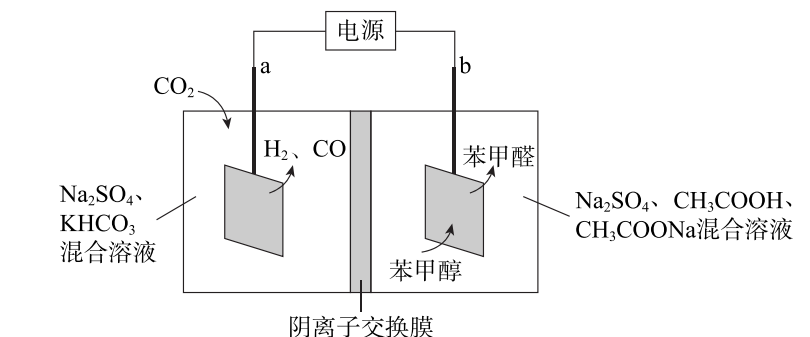
A. a电极连接电源的负极
B. SO42-从a极区向b极区移动
C. b极区中c(CH3COO-)逐渐增大
D. a极区中c(CO32-)逐渐增大
13. 以相同的流速分别向经硫酸酸化和未经酸化的浓度均为0.1 mol·L-1 的FeSO4溶液中通入O2。溶液中pH随时间的变化如下图所示。
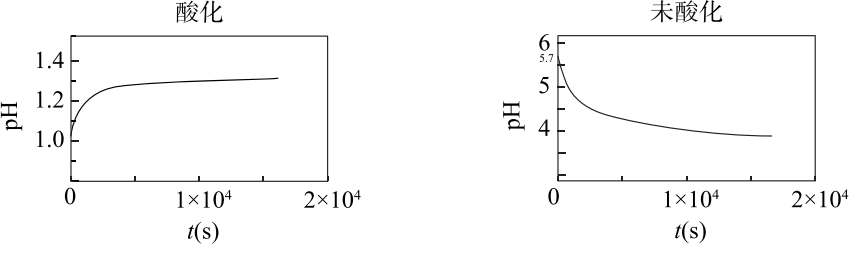
已知:0.1 mol·L-1 Fe3+生成Fe(OH)3,开始沉淀时pH=1.5,完全沉淀时pH=2.8
下列说法不正确的是
A. 由图1可知,酸化的FeSO4溶液中发生反应:4Fe2+ + O2 + 4H+ === 4Fe3+ + 2H2O
B. 图2中,t=0时刻,FeSO4溶液pH=5.7是由于Fe2+发生了水解反应
C. 由图2中可知,未酸化的FeSO4溶液中发生反应生成Fe(OH) 3的同时还生成了H+
D. 若向FeSO4溶液中先加入过量NaOH溶液再通入O2,pH先增大后显著减小
14.探究乙醛的银镜反应,实验如下(水浴加热装置已略去,水浴温度均相同)
已知:ⅰ.银氨溶液用 2% AgNO3溶液和稀氨水配制
ⅱ.[Ag(NH3)2]+ +2H2O Ag+ + 2NH3·H2O
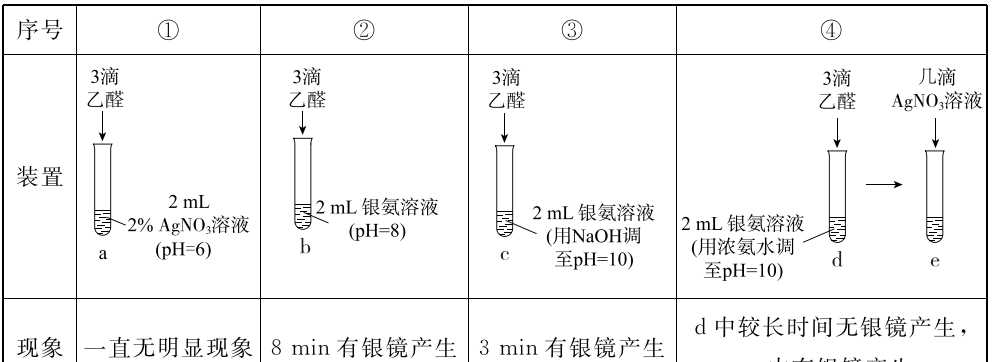
下列说法不正确的是
A. a与b中现象不同的原因是[Ag(NH3)2]+能氧化乙醛而Ag+不能
B. c中发生的氧化反应为CH3CHO + 3OH- - 2e- === CH3COO- + 2H2O
C.其他条件不变时,增大pH能增强乙醛的还原性
D.由③和④可知,c与d现象不同的原因是c(Ag+)不同
第二部分
本部分共5题,共58分。
15.(10分)
由氧元素形成的常见物质有H2O、H2O2、O2和O3等。
(1)基态氧原子的电子排布式是______。
(2)H2O分子的VSEPR模型是______形。
(3)对H2O2分子结构的研究,曾有以下推测:
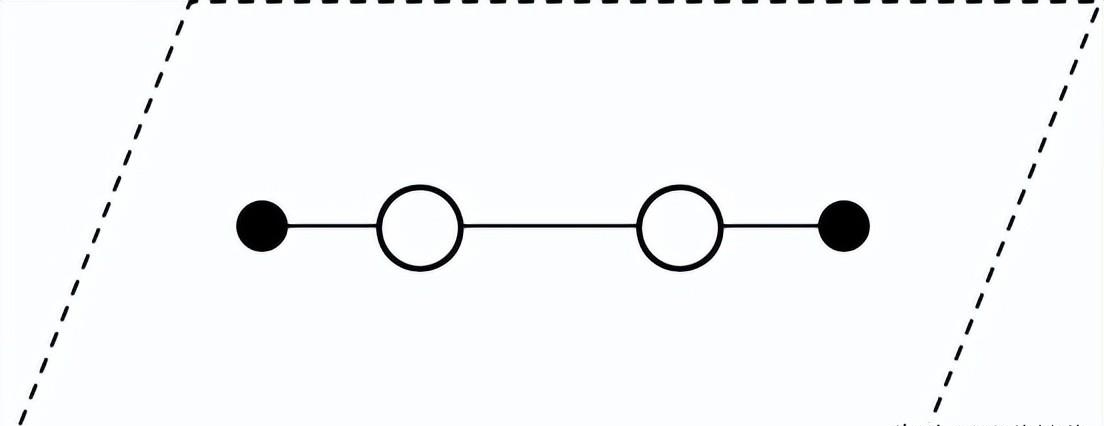
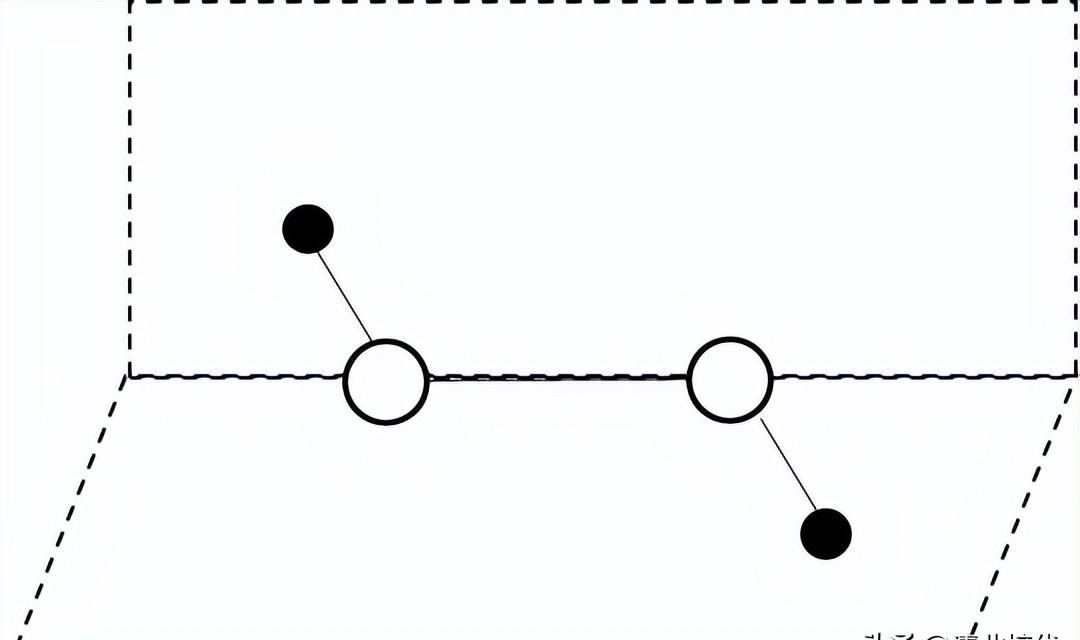
甲 乙
①根据测定H2O2分子中______(填字母序号),确定其结构一定不是甲。
a. H—O 键长 b. O—O 键能 c. H—O—O 键角
②由于H2O2不稳定,很难得到晶体。20世纪40年代初,卢嘉锡等化学家用尿素(
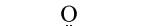
)与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。
a. H2O2为______(填“极性”或“非极性”)分子
b.用“X—H…Y”表示出上述晶体中形成的氢键:______。
(4)O2的晶胞为立方体,结构如下。
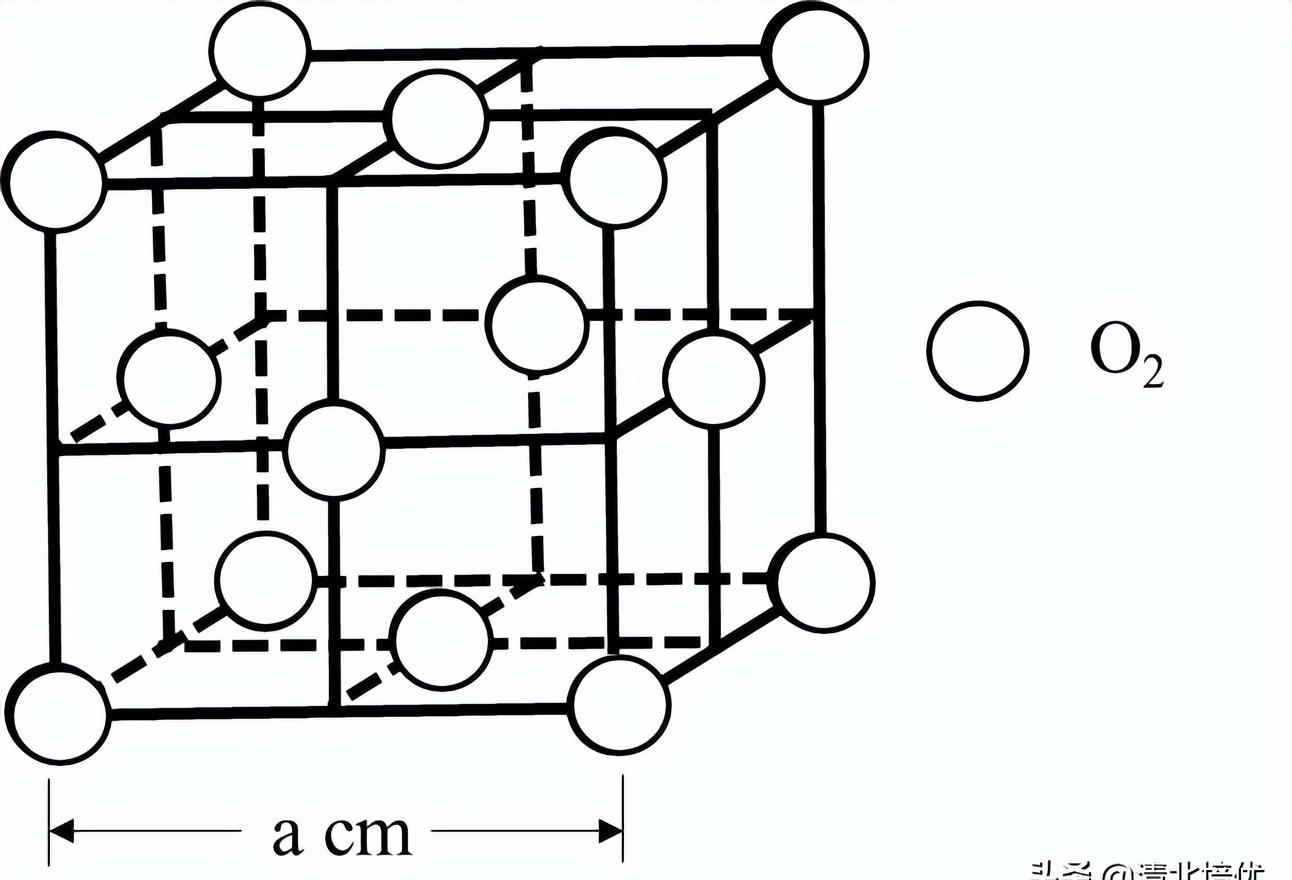
根据图中信息,可计算O2晶体密度是______ g·cm-3
(5)已知O3分子的空间结构为V形,中心O为 sp2杂化。除σ键外,O3分子中还形成了含4个电子的大π键。
每个O3分子中用于成键的电子总数是______个,中心O提供参与成键的电子数是______个。
16.(12分)
从矿石中提取金(Au)是获取贵金属的主要来源。
(1)俗话说“真金不怕火炼”,从化学性质角度解释其原因是______。
(2)硫代硫酸盐在弱碱性条件下浸金是提取金的一种方法。
①补全反应的离子方程式。
□Au +□S2O32- + O2 + □______ === □[Au(S2O3)2]3- + □______
②简述S2O32-在金被氧化过程中的作用:______。
(3)工业上常用CuSO4溶液、氨水和Na2S2O3溶液为原料配制浸金液,其一种可能的浸金原理示意图如下。
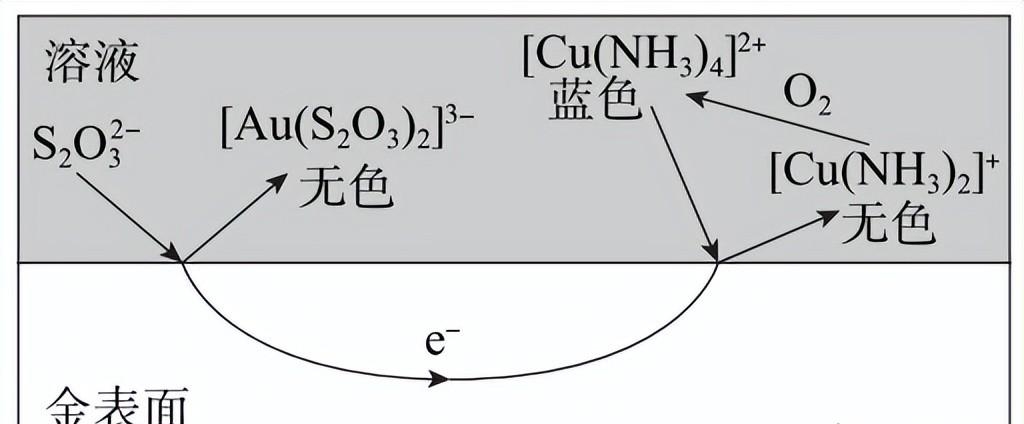
①由上述原理可知,[Cu(NH3)4]2+在浸金过程中起______作用。
②为了证明上述原理中O2的作用,进行如下实验。
实验现象:反应一段时间后,温度无明显变化,U形管内液柱左高右低,锥形瓶中溶液蓝色变浅,打开瓶塞后……
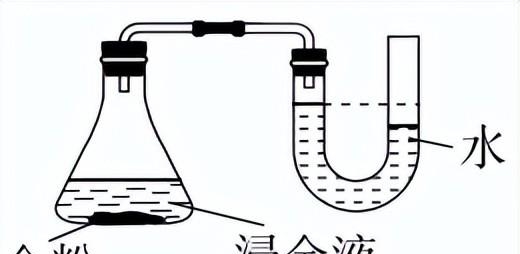
a. 打开瓶塞后,______(填实验现象),证实了上述原理。
b. a中现象对应反应的离子方程式是______。
③下图表示相同时间内,配制浸金液的原料中c(CuSO4)对浸金过程中S2O32-消耗率和浸金量的影响(其他条件不变)。
已知:2Cu2+ + 6S2O32- 2[Cu(S2O3)2]3- + S4O62-
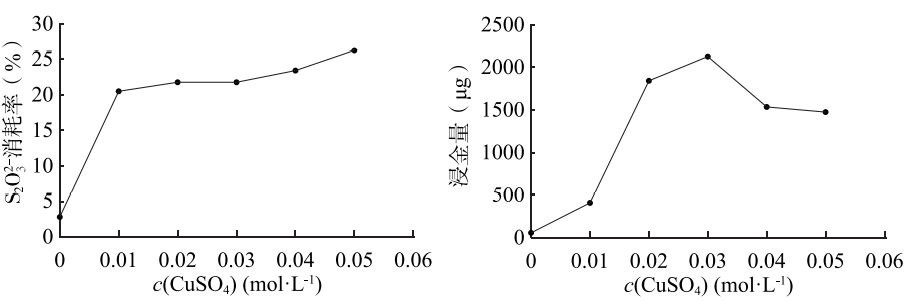
结合图1,解释图2中浸金量先上升后下降的原因:______。
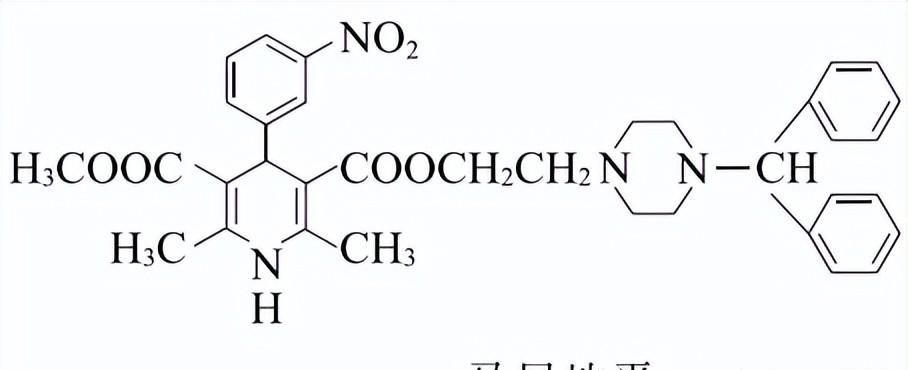
17.(12分)
马尼地平(结构简式如右图所示)主要用于治疗中度原发性高血压,其一种合成马尼地平的路线如下。
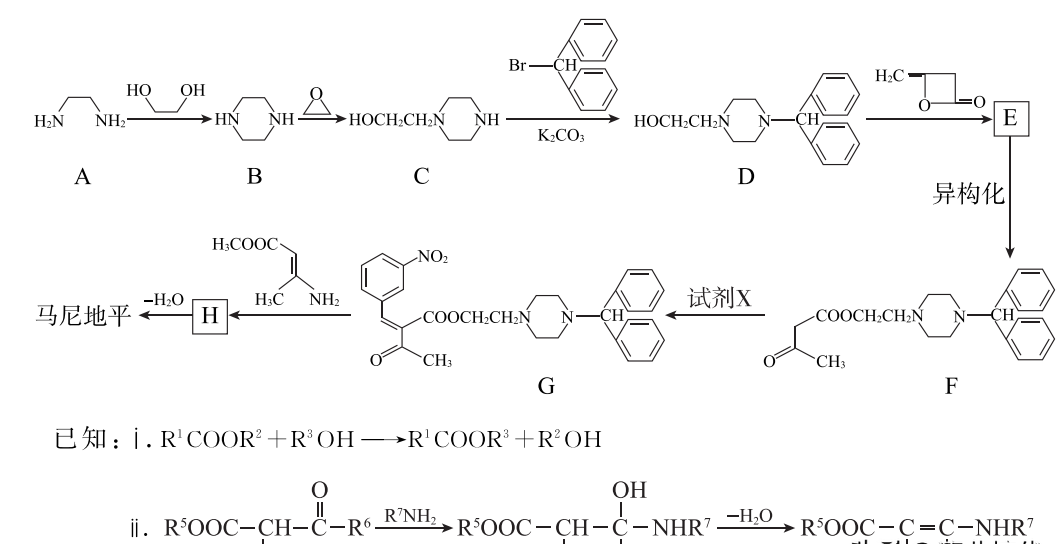
(1)A→B的反应方程式是______。
(2)C→D的反应类型是________。
(3)E中含氧官能团是________。
(4)试剂X的分子式为C7H5NO3,其结构简式是______。
(5)H分子中有两个含氮六元环,其结构简式是
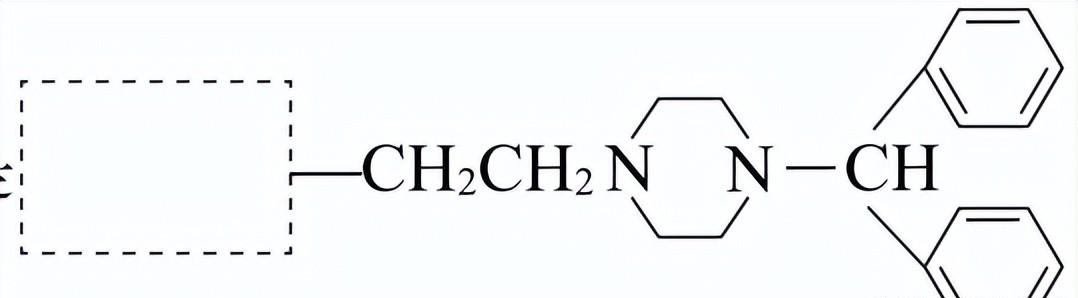
(在虚线框内将H的结构简式补充完整)。
(6)合成上述流程中
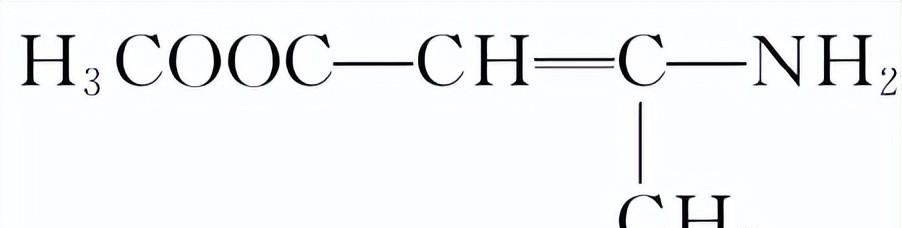
的一种方法如下。
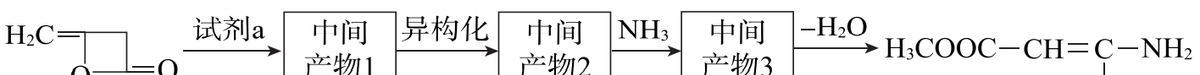
试剂a、中间产物2的结构简式分别是______、______。
18.(12分)
Mn及其化合物在工业生产中具有重要的用途。
Ⅰ.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。
(1)Mn在 (填“阳极”或“阴极”)生成。
(2)阳极泥中含有MnO2,写出产生MnO2的电极反应式: 。
Ⅱ. 阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。
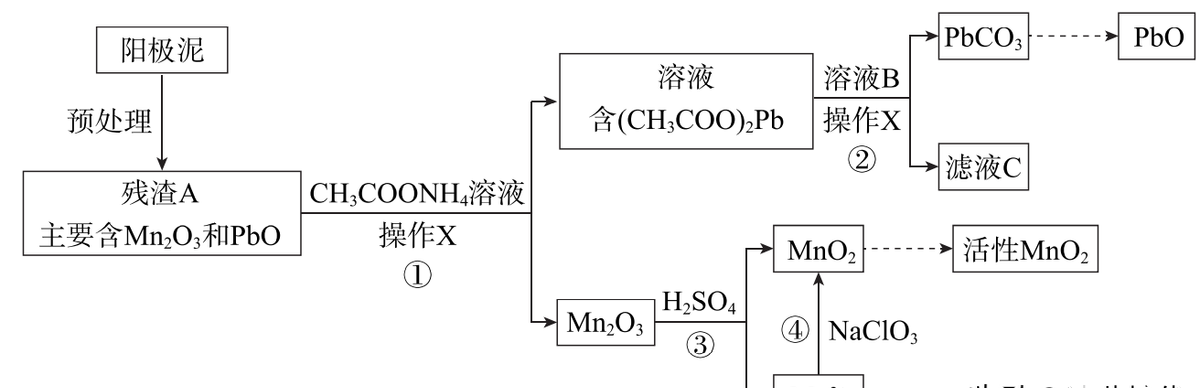
已知:(CH3COO)2Pb在水中难解离。
(3)操作X为______。
(4)①中反应的离子方程式为 。
(5)滤液C能循环使用,②中溶液B的溶质为 。
(6)a.为了将③中Mn2O3完全转化为MnO2,理论上④中加入的NaClO3与Mn2O3的物质的量之比为______(已知NaClO3的还原产物为NaCl)。
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是______。
(7)活性MnO2纯度的测定
ⅰ.用V1 mL c1 mol·L-1 Na2C2O4溶液(H2SO4酸化)溶解w g 活性MnO2样品。(MnO2 + C2O42- + 4H+ === 2CO2↑+ Mn2++ 2H2O)
ⅱ.用c2 mol·L-1 酸性KMnO4标准溶液滴定ⅰ中剩余的C2O42-,消耗KMnO4标准溶液V2 mL。
(5C2O42- + 2MnO42- +16H+ === 2Mn2+ +10CO2↑+ 8H2O)
样品中MnO2的质量分数=______ [M(MnO2) = 87g·mol-1]。
19.(12分)
实验小组同学为探究Fe2+性质,进行如下实验。
【实验Ⅰ】向 2 mL 0.1 mol·L-1 FeSO4溶液滴中几滴0.1 mol·L-1 KSCN溶液,无明显现象,再滴加几滴3% H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。
(1)甲同学通过上述实验分析Fe2+具有______(填“氧化”或“还原”)性。
乙同学查阅资料发现Fe2+与SCN-可发生反应,生成无色的配合物。为证实该性质,利用FeCO3进行如下实验。
(2)FeCO3的制备:用过量 NH4HCO3溶液与FeSO4溶液反应得到FeCO3,离子方程式为______。
【实验Ⅱ】验证Fe2+与SCN-发生反应
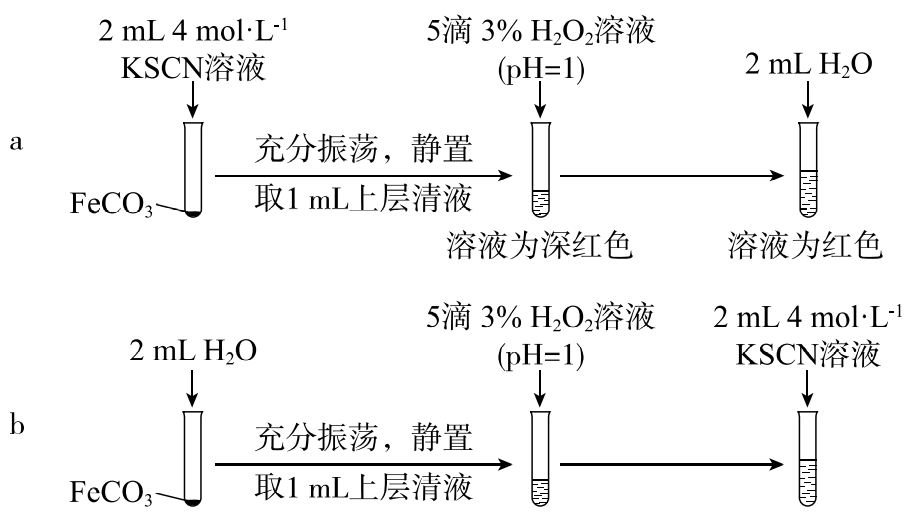
(3)通过实验b排除了______的干扰。
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是______。
丙同学设计实验进一步证明Fe2+可与SCN-反应。
【实验Ⅲ】
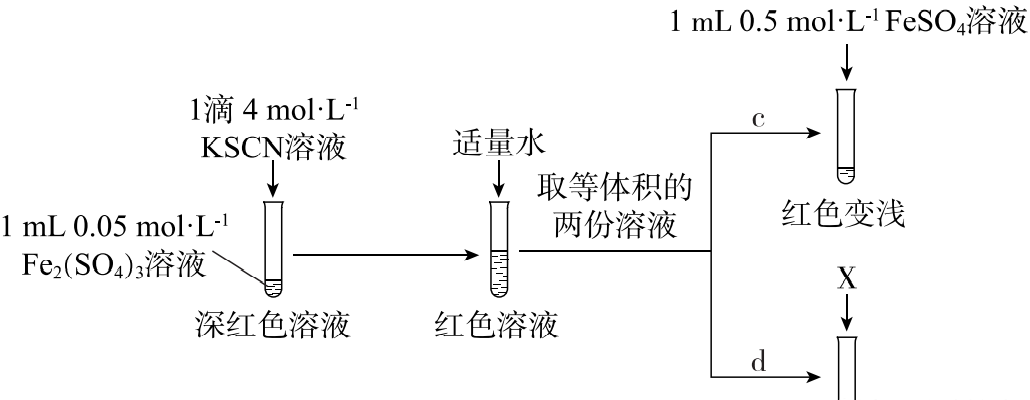
(5)上述实验中,d为c的对照实验。
①X为______。
②实验能够证实Fe2+可与SCN-反应,则应观察到的现象是______。
(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低c(Fe3+),______。
相关问答
-
强基计划36所大学录取分数线(强基计划36所大学录取分数线2022)

强基计划36所大学分数线北京大学:570分。清华大学:555分。复旦大学:550分。上海交通大学:540分。浙江大学:530分。南京大学:525分。中国
阅读更多 -
2022最火简短元宵节祝福语 元宵节祝福语【优秀2篇】

在学习、工作、生活中,大家总免不了要接触或使用祝福语吧,祝福语的种类很多,可分为吉日喜庆祝福语、寿诞祝福语、事业祝福语、祝酒词
阅读更多 -
2022年高考作文本手妙手俗手【精彩9篇】

无论本手,妙手与俗手,其实都可能相互成长,互相成全。多少次俗手与本手的经验才成就你妙手的回春,多少次妙手变俗手的试错才懂得本手的
阅读更多 -
2022最火简短元宵节祝福语 元宵节祝福语优秀2篇

圆月高悬看世间,惊叹人间聚团圆。亲情友情爱无限,甜蜜和美喜乐天。难怪嫦娥都羡眼,仙女都愿往人间。元宵节就要到了,快为自己的家人朋
阅读更多 -
2022年高考满分记叙文精彩7篇

作文(composition)是经过人的思想考虑和语言组织,通过文字来表达一个主题意义的记叙方法。读书破万卷,下笔如有神,以下是可爱的编辑
阅读更多 -
2022开学第一课观后感范文500字(优秀3篇)

《开学第一课》是由教育局和央视共同合作的一档教育类节目,是通过结合当下的一些时事热点,来启发中小学生的创造力与思考能力。以下
阅读更多
最新问答
-

“神十七”航天员乘组返回时间
2024-05-07 -

中级会计2024年什么时候开考
2024-05-07 -

2024重庆黔江普通话水平等级测试安排
2024-05-07 -
上海2024年5月普通话水平测试报名5月7日开启
2024-05-07 -

关于躬耕教坛强国有我演讲稿五分钟
2024-05-07 -

2017是中国人民解放军建军多少周年
2024-05-07 -

毕业生个人自我鉴定怎么写
2024-05-07 -

毕业生就业登记表自我鉴定范文
2024-05-07 -

2024毕业生就业登记表自我鉴定范文
2024-05-07 -

厄尔尼诺的定义标准
2024-05-07